Un estudio revela que las fuentes internas de energía de las células ayudan en secreto a combatir las bacterias: las mitocondrias juegan un papel clave en la respuesta inmune, al detectar la actividad bacteriana y ayudar a los neutrófilos a combatirla.
Un hallazgo reciente pone el foco en las mitocondrias, destacando su potencial para optimizar nuestras defensas. Conocidas como las “centrales energéticas” de las células, estos orgánulos tendrían además un papel secreto a la hora de combatir infecciones bacterianas.
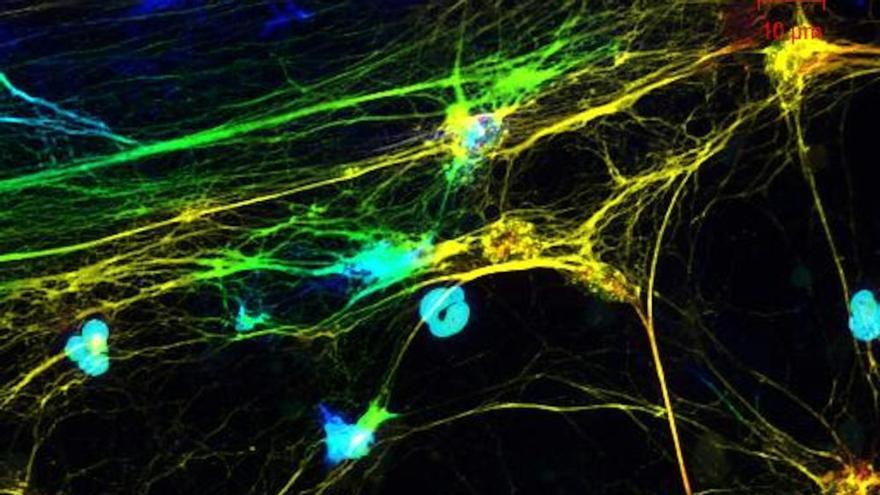
Según un equipo liderado por el inmunólogo Andrew Monteith, de la Universidad de Tennessee, en Estados Unidos, las mitocondrias que trabajan en neutrófilos, que son los glóbulos blancos más abundantes, son capaces de detectar señales metabólicas de las bacterias y desencadenar la formación de trampas extracelulares (NETs) para combatirlas y eliminarlas.
El papel clave de las mitocondrias
El estudio, publicado en Cell Host & Microbe, desarrolla cómo el metabolismo celular no solo genera energía, sino que regula decisiones críticas del sistema inmunitario. Hasta el momento, las mitocondrias se consideraban un vehículo pasivo de producción de ATP, pero a partir de esta investigación y de otras relacionadas ahora sabemos que también funcionan como verdaderos sensores intracelulares, capaces de “escuchar” el entorno metabólico y modular la respuesta inmune en consecuencia.
Según explica Monteith en un artículo publicado en The Conversation, los neutrófilos emplean varios mecanismos para neutralizar patógenos, pero uno de los más potentes es la liberación de NETs: una red de ADN enriquecido con proteínas antimicrobianas que atrapa microbios y evita su diseminación. Aunque se pensaba que la NETosis, o sea el proceso que las origina, se activaba por estrés oxidativo o daño celular, Monteith y colaboradores han identificado un nuevo disparador: el lactato bacteriano.
Durante la fagocitosis, las bacterias como Staphylococcus aureus liberan lactato en la cámara intracelular denominada fagosoma. Las mitocondrias de los neutrófilos detectan ese aumento de lactato como una señal de que los mecanismos habituales son insuficientes para destruir al invasor, e inducen la liberación de NETs.
Aplicaciones terapéuticas
Sin embargo, al bloquear genéticamente o farmacológicamente la capacidad mitocondrial de reconocer el lactato, los investigadores observaron que los neutrófilos perdían eficiencia para formar estas trampas y las bacterias escapaban con facilidad.
Referencia
Mitochondria sense bacterial lactate and drive release of neutrophil extracellular traps. Ashley D. Wise et al. Cell Host & Microbe (2025). DOI:https://doi.org/10.1016/j.chom.2025.02.003
En consecuencia, el descubrimiento tiene aplicaciones fuera del laboratorio: Monteith y su equipo demostraron que los neutrófilos de pacientes con lupus eritematoso sistémico (LES) presentan mitocondrias “desconectadas” de este sensor de lactato. Esta anomalía explicaría por qué quienes padecen esta enfermedad autoinmune muestran mayor predisposición a infecciones bacterianas severas, debido a un funcionamiento inadecuado de la NETosis frente a la amenaza microbiana.
Las implicaciones terapéuticas son variadas: incluyen intervenir en la ruta de detección mitocondrial para reforzar la capacidad de los neutrófilos frente a patógenos resistentes o, por el contrario, moderar una respuesta excesiva en enfermedades autoinmunes. De esta manera, los fármacos dirigidos a «afinar» estos sensores metabólicos abrirían una vía inexplorada en el tratamiento de infecciones y desórdenes inflamatorios crónicos.